« Anterior 24/11/2022 - 06:43 Próxima »
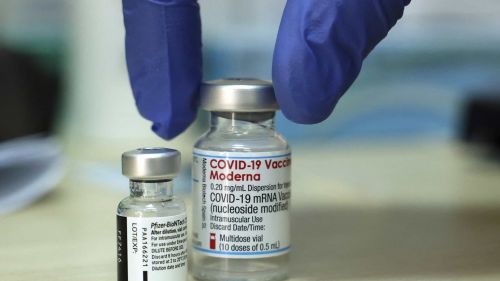
Anvisa aprova duas vacinas da Pfizer atualizadas para subvariantes da ômicron
A diretoria colegiada da Anvisa (Agência Nacional de Vigilância Sanitária) aprovou, nesta terça-feira (22), o uso emergencial de duas vacinas bivalentes contra a Covid-19 produzidas pela Pfizer. A vacina bivalente oferece imunização contra mais de uma cepa do coronavÃrus. A primeira versão apresentada pela fabricante foi desenhada com a cepa original do Sars-CoV-2 e a ômicron BA.1, que se alastrou rapidamente por todo o mundo. Também houve a aprovação de uma nova versão da vacina que possui a cepa original do vÃrus e conta com as sub variantes BA.4 e BA.5. As vacinas são indicadas como dose de reforço na população acima de 12 anos de idade, ou seja, após três meses da aplicação do esquema primário completo. Podem ser aplicadas também como segunda dose de reforço ou quarta dose. "Os dados permitem concluir que as vacinas bivalentes atualizadas irão resultar em benefÃcio clÃnico, com o aumento de proteção e da duração da proteção contra a variante e as sub variantes da ômicron, quando administradas como dose de reforço", disse o gerente-geral de Produtos Biológicos da Anvisa, FabrÃcio de Oliveira. Segundo ele, os resultados mostraram que as reações adversas foram em sua maioria de gravidade leve, moderada e de curta duração. As mais comuns foram dor no local de injeção, fadiga, dor de cabeça, dor muscular, calafrios, dor nas articulações, inchaço, diarreia e febre. "Não se teve nenhuma situação de preocupação adicional das vacinas bivalentes quando comparadas ao perfil de segurança da vacina monovalente original", completou. Fonte: Folhapress.
Comentários

Sobre * firminocaetanojunior
Recife - PE
 Presentear FlogVIP
Presentear FlogVIP Denunciar
DenunciarÚltimas fotos

27/04/2023

27/04/2023

27/04/2023

26/04/2023

26/04/2023
« Mais fotos